Teori Asam Basa Materi Kimia Kelas 11 – Dalam kehidupan sehari-hari, tentunya kita sering mendengar istilah asam. Asam sering digunakan untuk mengungkapkan rasa yang masam. Istilah asam berasal daria bahasa latin “asamus” yang berarti masam. Contohnya, lemon berasa asam karena mengandung asam sitrat, acar mentimun berasa asam karena menggunakan cuka yang merupakan asam asetat.
Sedangkan istilah basa biasanya jarang digunakan dalam kehidupan sehari-hari. Meskipun sebenarnya basa juga banyak kita temui di sekitar kita. Sifat basa pada suatu zat biasanya menimbulkan rasa yang pahit seperti pada busa sabun atau soda kue.
Asam dan basa sangat diperlukan bagi tubuh kita untuk membantu proses pencernaan maupun untuk keseimbangan pH darah.
Nah istilah asam basa secara sederhana dapat dibedakan dengan menilai derajat keasaman (pH) suatu zat. Nilai pH berada pada rentang 1-14. Suatu zat akan memiliki sifat asam jika memiliki pH dibawah 7 dan memiliki sifat basa jika memiliki pH diatas 7. Jika suatu zat memiliki pH=7 maka zat tersebut memiliki sifat netral.
Lebih dari itu, beberapa ilmuwan kimia menemukan penjelasan mengenai asam basa yang lebih dalam lagi. Yuk kita simak tabel berikut.
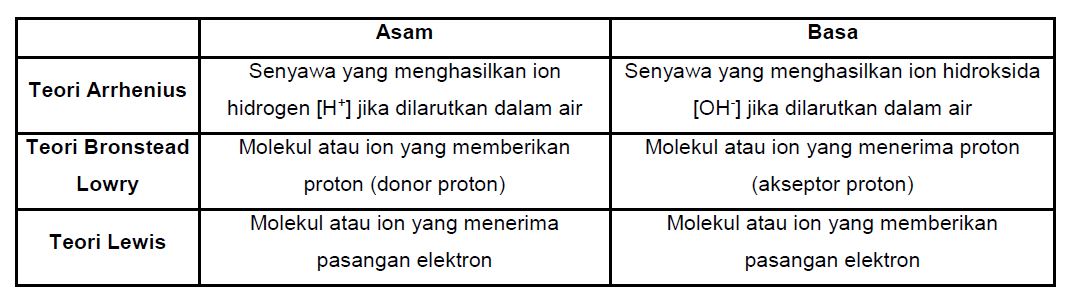
Teori Arrhenius
Teori ini membedakan asam basa dari ion yang dihasilkan jika senyawa dilarutkan ke dalam air.
Arrhenius mendefinisikan:
- Asam sebagai Senyawa yang menghasilkan ion hidrogen [H+] jika dilarutkan dalam air
- Basa sebagai Senyawa yang menghasilkan ion hidroksida [OH–] jika dilarutkan dalam air.
Teori ini memiliki beberapa kekurangan :
- Hanya dapat diaplikasikan dalam reaksi yang terjadi di air
- Tidak menjelaskan mengapa beberapa senyawa yang mengandung hidrogen dengan bilangan oksidasi +1 (seperti HCl) larut dalam air untuk membentuk larutan asam sedangkan yang lain seperti CH4 tidak
- Tidak dapat menjelaskan mengapa senyawa yang tidak memiliki OH– seperti Na2CO3 memiliki karakteristik seperti basa
Teori Bronsted Lowry
Teori ini membedakan asam basa menggunakan asumsi sederhana yaitu dengan transfer ion H+
Johanes Bronsted dan Thomas Lowry mendefinisikan :
- Asam adalah molekul atau ion yang memberikan proton (donor proton)
- Basa adalah Molekul atau ion yang menerima proton (akseptor proton)
Teori ini memiliki kekurangan tidak dapat menjelaskan bagaimana suatu reaksi asam basa dapat terjadi tanpa adanya transfer proton dari asam ke basa.
Teori Lewis
Teori ini membedakan asam basa berdasarkan proses transfer pasangan elektron. Pada dasarnya definisi asam basa yang dikemukakan oleh Lewis sama dengan yang dikemukakan oleh Bronsted Lowry karena suatu zat yang memberikan proton dapat disebut juga sebagai penerima pasangan elektron .
Lewis mendefinisikan :
- Asam adalah molekul atau ion yang menerima pasangan elektron
- Basa adalah molekul atau ion yang memberikan pasangan elektron
Demikian teori mengenai asam basa. Semoga bermanfaat!
