Kunci Jawaban IPA SMA Kelas X Konfigurasi Elektron – Halo sobat gurune, konfigurasi elektron membahas tentang susunan elektron dalam sebuah atom dan bagaimana susunan ini mempengaruhi sifat dan perilaku zat. Dengan pemahaman konfigurasi elektron, kita dapat memprediksi sifat dan perilaku suatu unsur, serta memahami bagaimana unsur-unsur dalam tabel periodik saling berhubungan.
Nah, kali ini kita akan belajar tentang konfigurasi elektron. Pembahasan soal ini terdapat pada buku Ilmu Pengetahuan Alam SMA Kelas X kurikulum merdeka. Berikut adalah pembahasan soal selengkapnya !
Kunci Jawaban IPA SMA Kelas X Konfigurasi Elektron Halaman 115
Intisari
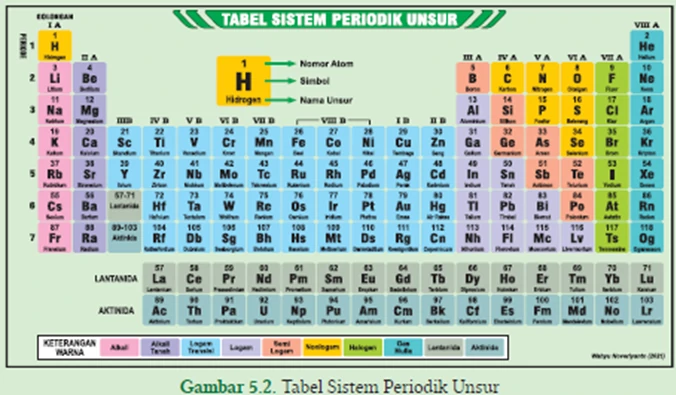
Mendeskripsikan Bagian Tabel Periodik Modern Tabel periodik unsur yang Kalian kenal saat ini adalah sistem periodic modern atau dikenal dengan sistem periodik bentuk panjang yang dicetuskan oleh Henry G Moseley. Kenaikan nomor atom menjadi dasar penyusunan unsur dalam sistem periodik ini sehingga sifat-sifat unsur adalah fungsi periodik dari nomor-nomor atomnya. Telah diulas sebelumnya bahwa nomor atom melambangkan jumlah electron sedangkan elektron tersusun sebagai konfigurasinya masing-masing dalam atom tersebut.
Baca Juga : Kunci Jawaban IPA SMA Kelas X Struktur Atom
Tampilan tabel periodik bentuk panjang terdiri dari golongan dan periode. Dalam tabel periodik modern, atom dengan konfigurasi elektron yang serupa ditempatkan dalam satu kolom yang sama. Kolom ini dinamakan golongan yang dibaca dari atas ke bawah. Golongan menyatakan jumlah elektron kulit terluar (elektron valensi) suatu atom dari unsur tersebut. Sedangkan periode merupakan deretan unsur-unsur yang disusun berdasarkan peningkatan nomor atom berurutan dari kiri ke kanan. Periode mendeskripsikan jumlah kulit atom yang dimiliki oleh atom unsur tersebut.
Tabel periodik bentuk panjang terdiri dari 18 golongan dan 7 periode yang diuraikan sebagai berikut.
Bagian Horizontal
- Terdiri dari 7 baris horizontal disebut periode. Unsur-unsur pada periode disusun berdasarkan urutan nomor atom.
- Periode ke-1 adalah periode terpendek yaitu terdiri dari 2 unsur “H” dan “He”.
- Periode ke-2 dan ke-3 masing-masing memiliki 8 unsur.
- Periode ke-4 dan ke-5 masing-masing memiliki 18 unsur.
- Periode ke-6 memiliki 32 unsur. Ke-15 unsur diantaranya merupakan deret Lantanida atau logam tanah jarang (nomor atom 57-71). Unsur Sc dan Y juga dikelompokkan ke dalam LTJ sehingga jumlah unsur LTJ adalah 17 buah. Deret lantanida letaknya terpisah dari tabel yaitu pada bagian bawah tabel. Logam tanah jarang memiliki sifat-sifat yang mirip satu sama lain. Ingat bahasan artikel pada awal Bab ini.
- Periode ke-7 terdiri dari unsur-unsur lainnya yang jumlahnya masih terus bertambah. Ke-15 unsur diantaranya merupakan unsur-unsur deret aktinida (nomor atom 89-103). Posisi deret aktinida juga terpisah dari tabel yaitu diletakkan pada bagian bawah tabel. Sebagian besar unsur deret aktinida merupakan unsur transuranium dengan nomor atom di atas 92.
Bagian Vertikal
- Kolom yang vertikal disebut golongan.
- Ada 18 golongan.
- Golongan dibagi menjadi 2 yaitu golongan utama (A) dan golongan transisi (B).
- Golongan utama terdiri dari golongan I A hingga VIII A (golongan 1 A hingga III A adalah unsur logam sedangkan golongan IV A hingga VIII A adalah nonlogam).
- Unsur B, Si, Ge, As, Sb, Te, Po, dan At adalah unsur-unsur semilogam atau metaloid.
- Golongan transisi terdiri dari golongan I B hingga VIII B yaitu unsur-unsur logam transisi.
- Golongan lantanida dan aktinida juga dikelompokkan sebagai unsurunsur logam transisi.
Mengetahui konfigurasi elektron dari atom suatu unsur akan memberikan informasi letak unsur pada periode dan golongan dalam tabel sistem periodik. Jumlah kulit yang dimiliki atom merupakan letak unsur pada periode sementara jumlah elektron valensi adalah letak unsur pada golongan utama maupun transisi.
Baca Juga : Kunci Jawaban IPA SMA Kelas X Hukum Kekekalan Massa (Hukum Lavoisier)
Ayo Berlatih
Carilah data nomor atom dan nomor massa dari unsur aluminium dan unsur kalsium pada tabel sistem periodik. Buatlah konfigurasi elektron kedua unsur tersebut menggunakan diagram teori model atom Bohr (lihat contoh pada Tabel 5.4). Tentukan jumlah kulit dan jumlah elektron valensinya.
Jawaban :
27
13 Al
Konfigurasi elektron model atom Bohr = 2. 8. 3
Jumlah kulit atom = 3
Periode ke-3
Jumlah elektron valensinya = 3
Golongan III A
40
20 Ca
Konfigurasi eletron model atom Bohr = 2. 8. 8. 2
Jumlah kulit atom = 4
Periode ke-3
Jumlah elektron valensinya = 2
Golongan II A
Kesimpulan
Demikianlah informasi yang dapat disajikan. Semoga dengan pembahasan soal di atas dapat mempermudah sobat dalam belajar.
Baca Juga : Kunci Jawaban IPA SMA Kelas X Soal Latihan tentang Hubungan Bilangan Avogadro dan Jumlah Mol
Disclaimer :
- Jawaban dan pembahasan pada postingan ini mungkin akan berbeda dengan jawaban sumber lain.
- Jadikan postingan ini sebagai salah satu bahan referensi dalam menjawab soal bukan sebagai acuan utama dan satu-satunya.
- Postingan ini tidak mutlak kebenarannya.
